UDI各国之间的差异
在信息时代背景下,UDI是国际医疗器械监管的先进手段,是医疗器械实现全球可追溯的“通用语言”。
UDI的全称是Unique Device Identification,即“唯一器械标识”。
UDI包括两个部分:器械标识(Device Identifier,DI)和生产标识(Production Identifier,PI)。
UDI是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。
UDI最早由美国于2013年率先实施,近年来逐渐为其他国家所采用和实施。国内医疗器械UDI要求自2019年10月1日起分批次正式执行。
那么,各国之间UDI政策之间到底有什么差异呢?下面是中国,欧盟和美国UDI差异分析:
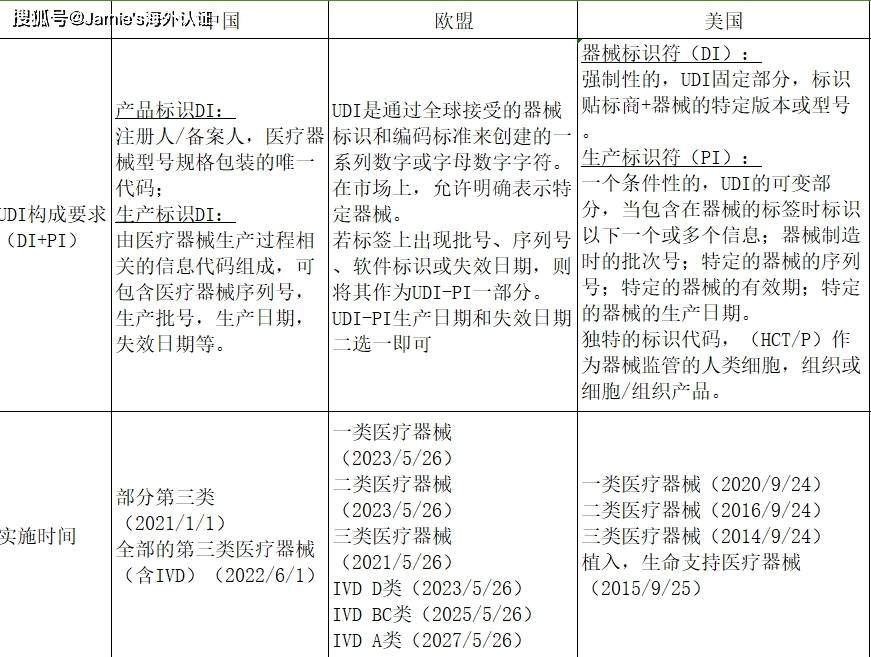
那么中国与美国UDI政策究竟有什么差异?这几点一定要注意:
1.发码机构差异
目前来说,我国认可的发码机构主要为三家,分别是中国物品编码中心、中关村工信二维码技术研究院和阿里健康技术(中国)有限公司。其中,中国物品编码中心隶属于国家市场监督管理总局,是统一组织、协调、管理我国商品条码、物品编码与自动识别技术的专门机构,也是国际物品编码组织在中国的分支结构.需要注意的是,目前只有GS1一家机构能同时满足中国、欧盟和美国的要求。ZIIOT是专注于二维码技术研究和标准制定的科研服务机构,2018年ZIIOT获得了国际标准化组织、欧洲标准委员会、国际自动识别与移动技术协会三大国际组织的共同认可。阿里健康技术(中国)有限公司在2015年8月建立了网上追溯平台“码上放心”,向企业提供产品全生命周期追溯服务。这三家发码机构各有特色,企业可以根据实际需求进行选择。
美国授权的三家发码机构分别为国际物品编码组织、国际血库自动化委员会 和健康行业商业交流委员会。三个发码机构根据各自不同的标准,运行各自的UDI分配系统。
2.数据库差异
医疗器械唯一标识数据库是UDI系统必不可少的一部分。2019年,UDID上线运行,向企业开放产品标识和数据申报等功能。目前,数据库可以通过查询、下载、应用程序接口对接3种方式对医疗器械全生命周期各方进行共享服务。
美国作为最早实施UDI系统的国家,其数据库称为GUDID,只有企业和发码机构注册GUDID账号才有权限进入。2015年,为了方便公众免费查询、下载UDI信息,FDA与美国国立医学图书馆建立了AcessGUDID。
我司专注办理FDA注册|510K申请|美国代理人服务|欧盟CE认证|欧盟授权代表|英国UKCA、MHRA注册|澳洲TGA认证及代理人等.更多咨询请联系客服:jiamei_info









评论